A restrikciós enzimek (a DNS-t megszabott szekvenciánál hasító
fehérjék) felfedezése óta a levegőben van, hogy a molekuláris biológia
"kátenpészt" ekvivalensével - azaz gének és szabályozó szekvenciáik
szabad kombinálásával - teljesen új feladatokra "programozhatunk" át
baktériumokat (és nemcsak). Ennek az egyik primitívebb (bár nem haszon
szempontjából) kivitelezése egy-egy különálló gén bevitele a
gazdaorganizmusba, lásd még: inzulin termelő baktériumok vagy a
genetikailag manipulált növényfajok.
Azonban összetett szignál
átviteli mechanizmusok beépítése, bár elvileg minden adott volt rá,
sokáig váratott magára. A jég az elmúlt
hónapokban látszott igazán megtörni, hiszen egyre több "biológiai
szenzorról" és más szintetikus biológiával előállított organizmusról
szóló hír jelent meg a populáris médiában. Az első csoportra jó példa
az a bakteriális "szenzor" (1. Ábra) amely bizonyos kémiai-gradiensek
érzékelésére alkalmas: a különböző koncentrációt különböző színek
kibocsájtására programozott bacik érzékelik [1].
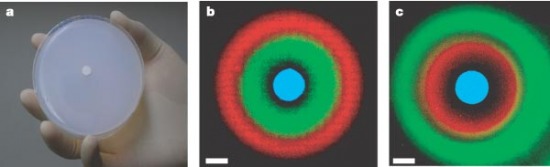
1. Ábra: Az agar lemezre kétfajta baci egyvelegét kenték fel: az egyik kisebb, a másik nagyobb AHL (acil-homoszerin lakton, igazából indifferens, hogy mi ez) koncentráció érzékelésére alkalmas. Mint azt a (b) és (c) mutatja, a riporter színek könnyen felcserélhetőek, így a magas AHL koncentrációt (UV fényben) előbb a zöld majd a piros szín jelzi. (A középen található "forrás" UV fényben kékes színt bocsájt ki). [1]
A szintetikus biológia "műfajának" felpörgetése végett az MIT diákversenyeket kezdett néhány éve rendezni biomérnökönek, először csak házon belül, aztán egyre szélesebb körben. Az idei iGEM (intercollegiate Genetically Engineered Machine) versenyen már igazi nemzetközi mezőny indult a lehető legkülönfélébb projectekkel. Ezekből az egyik az eheti Nature-ben publikálásra is került [2,3]. Az austini csapat egy biofilmet hozott létre és nemcsak a klasszikus értelemben (vékony, élő sejtekből álló réteg), hanem a dagerotípiák szellemében. A bakteriális genetika kis házi kedvencét, az E. coli-t bütykölték tovább, és egy kékalga fotoreceptorát fehasználva olyan kiméra transzmembrán fehérjét hoztak létre, amely fény hiányában folyamatosan aktivál egy fekete színt létrehozó fehérjét, azonban ha fény éri inaktívvá válik. Ezért a bacikat kikenve egy agar lemezre és egy adott minát rájuk világítva a minta hamarosan megjelenik a lemezen (2. Ábra). (Valódi intelligens dizájn, kéremszépen... ;-)))
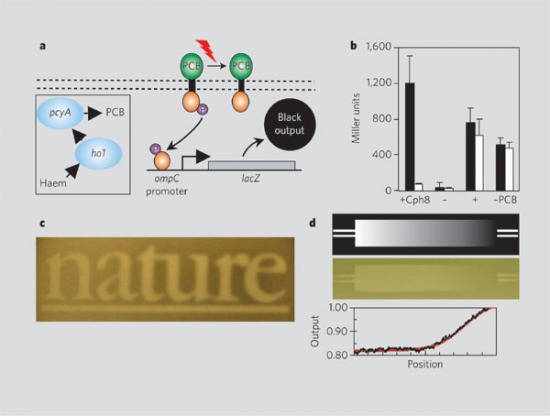
2. Ábra: A kiméra fotoreceptor (Cph8) fény hiányában egy hisztidin-foszfatázon keresztül aktiválja a fekete színt előállítő lacZ gén átíródását, de fény hatására a folyamat inaktiválódik (a). Ezért a bakteriális biofilmre vetített káp "lenyomata" látszani fog (c), sét elméletileg akár különböző árnyalatok is megjeleníthetők valamilyen szinten (d). [3]
A hosszútávú cél azonban sokkal magasabbra törőbb. Egy olyan katalógus létrehozása
ahonnan különböző műveletek elvégézésére alkalmas, egymással
kompatibilis gének és egyéb moduláris DNS darabok lennének rendelhetők.
Ezek segítségével aztán ugyanolyan egyszerűen lehetne biológiai
hálózatokat létrehozni mint ahogyan elektromos áramköröket bütykölünk
fizika órán. (Lehetne, de azért egyelőre még nem ilyen egyszerű a
helyzet, mint azt az iGEM több csoportjának esete is mutatja: a
biológiai rendszerek stochasztikusak, néha kiszámíthatatlanok, így
gyakran több próbálkozásba kerül egy-egy működőképes "bio-áramkör"
létrehozása, nem mindig triviális okokból - egyszerűen még számos,
hosszú ideje használt fehérjéről sem tudjuk 100% bizonyossággal, hogy
új körülmények között hogyan fog szuperálni.)
Mindenesetre kedves
gyakorló és leendő szülők lassan jobb lesz lelkileg felkészülni: a
Lego-Technik a múlté, lehet gyűjtögetni a SynthBio-Legóra... ;-))
[1] Basu S, Gerchman Y, Collins CH, Arnold FH, Weiss R. (2005) A synthetic multicellular system for programmed pattern formation. Nature 434: 1130-1134.
[2] Check, E. (2005) Synthetic biology: Designs on life. Nature 438: 417-418.
[3] Levskaya A, Chevalier AA, Tabor JJ, Simpson ZB, Lavery LA, Levy M, Davidson EA, Scouras A, Ellington AD, Marcotte EM, Voigt CA. (2005) Synthetic biology: Engineering Escherichia coli to see light. Nature 438: 441-442.



Utolsó kommentek