Ha valaki szeret elgondolkozni a kutyavilág sokféleségén, akkor érdemes a fejébe vésnie Elaine Ostrander nevét, mivel a hölgy (és laboratóriuma) jelenleg igencsak bő forrása a legkülönbözőbb jellegek genetikai térképezésének. Az ő nevéhez fűződik, a kis eb-termet és az IGF1 gén adott allélja közti összefüggés megállapítása, a végtaghossz-különbözőségek fejlődési okának beazonosítása (jelen poszt témája), illetve a különböző szőrzettípusok genetikájának tisztázása (erről, remélem, hamarosan).
A rövid végtaggal rendelkező kutyák (pl. tacskók, bassett houndok) esetében, az már régóta világos volt, hogy egy örökletes fejlődési rendellenességről van szó: valamilyen oknál fogva azok a sejtek, amelyek a csont növekedését kellene szolgálják, idő előtt befejezik az osztódást és maguk is "elcsontosodnak". (A deformált és rövid végtagok jelenlétének klinikai neve chondrodysplasia.) A miértre azonban eddig nem tudtuk a választ.
Ostranderék egy hatalmas adathalmazt gyűjtöttek össze, több száz kutya genomját (és a benne levő genetikai polimorfizmusokat) képesek megvizsgálni rövid idő alatt, aminek oroszlánrésze van abban, hogy viszonylag gyorsan tudnak érdekes tulajdonságoknak a genetikai okaira rákeresni.
Számos rövid ill. hosszú lábú eb fajta összehasonlításából aztán kitűnt, hogy a jelleg nagyon is kapcsolódik a 18. kromoszóma egy adott részén felfedezhető polimorfizmusokhoz, ami kevésbé szakzsargonban azt jelenti, hogy valahol ezek mellett van az a mutáció, amihez a jelleg köthető.
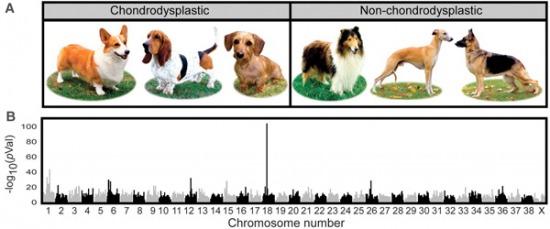
Érdekes módon, a standard kutyagenomban nem nagyon lehet fellelni egyetlen izgalmas gént sem a közelben, aminek egészen prózai oka van: nem egy "tradicionálisan" itt levő génben van a mutáció.
A chondrodypláziás kutyák esetében egy hívatlan vendég jelent itt meg: egy fgf4 retrogén. Mit is jelent ez: az fgf4 normál esetben egy négy exonból és három intronból álló gén (érdekes módon szintén a 18. kromoszómán van, de valahol nagyon máshol, mint a vizsgált régió). Az intronok aztán a transzkripció során/után kivágódnak, és így jön létre a bő 600 bázispár hosszúságú mRNS, ami aztán a fehérje szintézissorán lefordítódik. A vizsgált retrogén azonban egyáltalán nem rendelkezik intronokkal: szekvenciája szinte hajszálra megegyezik az érett mRNS-ével, aminek az a prózai oka van, hogy abból keletkezett. Egy véletlennek köszönhetően, egy ivarsejtben, feltehetően a retrotranszpozon aktivitásának köszönhetően jelenlevő reverz transzkriptáz a transzpozon saját genetikai állománya mellett egy fgf4 mRNS molekulát is "visszafordított" DNS-re, visszacsempészve a genomba. Az így keletkező új "retrogén" történetesen olyan szabályozó szekvenciák közelébe került, amelyek a fejlődés egy adott (csontfejlődés szempontjából kritikus) szakaszában aktiválják a gént a csontnövekedésért felelős sejtekben, amely nem kívánt aktivitásnak aztán egyenes következménye a chondrodyspláziás fenotípus.
A megfigyelés nem teljesen meglepő, mert egerekben és emberekben egyaránt az FGF jelátviteli úthoz lehet gyakran kötni a hasonló jellegű betegségeket. Ami azonban nem triviális, hogy a sok, egyébként igencsak különböző, rövid lábú fajtában ugyanaz a ritka mutáció felelős a jelleg megjelenéséért. Ez ugyanis azt jelenti, hogy még a kutyaszelídítés hajnalán jelent meg ez a mutáció a kutyaállományban és azóta is fennmaradt az emberi ízlésnek és gondoskodásnak köszönhetően.
Parker HG, VonHoldt BM, Quignon P, Margulies EH, Shao S, Mosher DS, et al. (2009) An expressed fgf4 retrogene is associated with breed-defining chondrodysplasia in domestic dogs. Science 325: 995-998.



Utolsó kommentek