 Mint azt két hete már beígértem, most az Ostrander laboratórium egyik legutóbbi eredményéről lesz szó, amiben a különböző kutya szőrtípusok genetikai eredetének erednek nyomába.
Mint azt két hete már beígértem, most az Ostrander laboratórium egyik legutóbbi eredményéről lesz szó, amiben a különböző kutya szőrtípusok genetikai eredetének erednek nyomába.
Kettős megközelítést használtak: egyrészt azt figyelték, hogy léteznek-e olyan genetikai markerek, amelyek hosszú szőrű/ drótszőrű/ pofaszakállás fajták egyedeiben szinte kivétel nélkül jelen vannak, míg más fajtákban nagyon ritkák. Másrészt kiemelten foglalkoztak egy olyan fajtával, ahol mindezen szőrzet jegyek egyaránt megfigyelhetők: a tacskókról van szó.
Az eredmények egyik érdekessége, hogy a legváltozatosabb fajok esetében ugyanazokat a mutációkat tudták az említett szőrzetjegyekért felelőssé tenni, a másik pedig az, hogy több, megvizsgált farkaspopulációból ezek a mutáns allélvariánsok egyaránt hiányoztak, vagyis a mutációk az ebszelídítés során alakultak ki, és nem pusztán már eredendően, egy ősi populációban meglevő genetikai sokszínűségről van szó, amelyből az emberi ízlés választott ki aztán valami neki tetszőt.
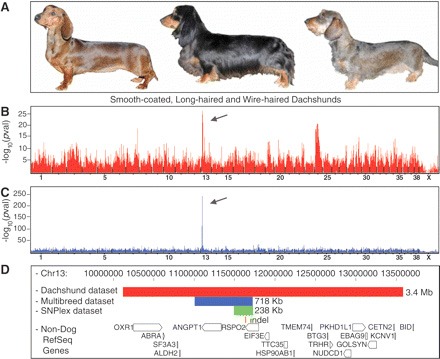 Legelőször a pofaszakállért és kiemelkedő szemöldökért felelős gént azonosították. A markerek mind a tacskók (B), mind a több fajtára kiterjedő vizsgálat esetén (C), a 13. kromoszóma egy adott régiójára mutattak. Itt a R-spondin-2 (RSPO2) gén található, ami azért izgalmas, mert ez bizonyítottan össze tud játszani egy olyan jelátviteli útvonallal (az ún. kanonikus Wnt-el), amelynek közismerten fontos jelentősége van a szőrszálak kialakításában.
Legelőször a pofaszakállért és kiemelkedő szemöldökért felelős gént azonosították. A markerek mind a tacskók (B), mind a több fajtára kiterjedő vizsgálat esetén (C), a 13. kromoszóma egy adott régiójára mutattak. Itt a R-spondin-2 (RSPO2) gén található, ami azért izgalmas, mert ez bizonyítottan össze tud játszani egy olyan jelátviteli útvonallal (az ún. kanonikus Wnt-el), amelynek közismerten fontos jelentősége van a szőrszálak kialakításában.
A mutáció érdekessége azonban az, hogy nem okoz változást az RSPO2 fehérje szekvenciájában, ugyanis egy olyan (167 bp hosszú) inszercióról van szó, amelyik az mRNS nem-fehérje kódoló régiójába esik. Hatására azonban a bőrben háromszorosára nő az RSPO2 átíródása, és ez állhat a jellegzetes fenotípus mögött.
Hasonló logikával azonosították a szőrhosszt, ill. a drótszőrűség jelenlétét befolyásoló géneket. Előbbiért egy növekedési faktor, az FGF5 a felelős, míg utóbbiért egy keratint kódoló gén , a KRT17 a felelős. Mindkettő logikus jelölt, az előbbit talán nem kell részleteznem miért (szőrhossz, növekedési faktor, kössük össze a pontokat...), míg utóbbinál annyit kell megjegyezni, hogy a keratin lényeges komponense minden szaruképződménynek, így a szőrnek is. Mindkét mutáció a gének által kódolt fehérje aminosavsorrendjében okozott változást: az FGF5 esetében Cys95Phe változás vehető észre, míg KRT17-nél egy Arg151Trp.
Mint a poszt elején utaltam rá, Ostranderék egy hatalmas genom-adatbázist végignyálazva arra jöttek rá, hogy ezek a mutációk szinte minden fajtában (egész pontosan az esetek 95%-ban) megmagyarázzák a különböző szőrzetek formáját. (Kivétel azért akad: a hosszú szőrű afgán agarak esetében a fenotípus egyáltalán nem mutat kapcsolatot az FGF5 körüli kromoszómarégióval, és a szóbanforgó mutációnak sem lelték nyomát.)
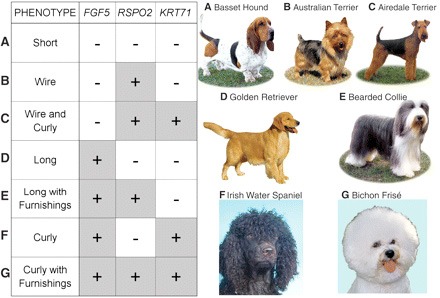 A rövid szőrű fajtáknál (A) mind a három génnek az ősi, "vad típusú" allélja lelhető fel. Pofaszakállasoknál (B), az RSPO2 mutáns allélja van, míg pofaszakállal rendelkező drótszőrűeknél mutáns RSPO2 és KRT17 lelhető meg (C). A hosszú szőrű golden retriever a mutáns FGF5 allélt hordozza (D), míg a szakállas colliek emellett egy mutáns RSPO2-t is (E). Satöbbi, lásd mellékelt ábra.
A rövid szőrű fajtáknál (A) mind a három génnek az ősi, "vad típusú" allélja lelhető fel. Pofaszakállasoknál (B), az RSPO2 mutáns allélja van, míg pofaszakállal rendelkező drótszőrűeknél mutáns RSPO2 és KRT17 lelhető meg (C). A hosszú szőrű golden retriever a mutáns FGF5 allélt hordozza (D), míg a szakállas colliek emellett egy mutáns RSPO2-t is (E). Satöbbi, lásd mellékelt ábra.
A témához csak érintőlegesen kapcsolódik, de azért mégis idekerül: Ostranderék kutatásáról először aznap hallottam, amikor a cikk felkerült a Science honlapjára, történetesen "személyesen" Elainetől. Azért idézőjelben, mert ugyan élőben hallottam az egész sztorit, ő maga fizikailag nem volt jelen az edinburghi fejlődésbiológia konferencián, hanem otthonról, telefonon nyomta le az egész prezentációját. Ami azért is tanulságos, mert jól mutatja, hogy nagyon is lehet olyan konferenciákat szervezni, ahol az előadók egy része nincs jelen. Sőt: ugyanaz a technika, aminek segítségével egy-egy szomszédos terem kivetítőjére át tudják játszani a megtelt előadók képanyagát, simán alkalmas lenne arra is, hogy az internetre feltegyék azt, vagyis sokkal szélesebb hallgatóságot elérhetnének, mint így. Jómagam egyébként igen szkeptikus vagyok azokkal az utópisztikus jövőképekkel, hogy hamarosan olyan konferenciák lesznek, ahol senki nem mozdul ki otthonról, hanem hatalmas képernyők biztosítják a szinte tökéletes "együttlét" élményt a világ távoli pontjain levő emberek számára, mert a valódi hús-vér interakciót ez nem váltja ki. De lesznek olyanok akik nem tudnak elmenni egy-egy konferenciára (anyagi, vagy személyes okból) és ilyen esetekben nagyon-nagyon hasznosak lehetnek az efajta technológiai újítások: hiszen a tudomány célja végső soron az, hogy minnél több emberhez eljusson egy-egy új felfedezés, kutatási eredmény híre.
(A három kistacskó képe a dachshundlove blogról származik.)
Cadieu E, Neff MW, Quignon P, Walsh K, Chase K, et al. (2009) Coat variation in the domestic dog is governed by variants in three genes. Science 326: 150-3.


 A
A 
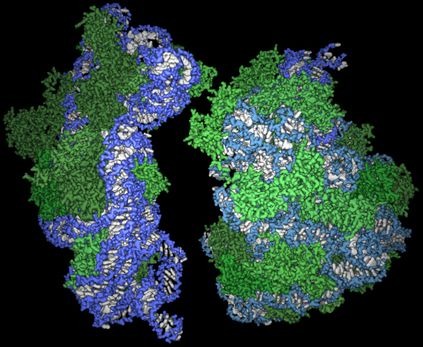 Rövidre fogva, a kémiai Nobelt idén a mellékelt ábrán látható gyönyörű és bonyolult struktúra feltárásáért
Rövidre fogva, a kémiai Nobelt idén a mellékelt ábrán látható gyönyörű és bonyolult struktúra feltárásáért  Szóval, miről is van szó. A telomérák az eukarióta kromoszómák végén levő rövid, ismétlődő szakaszok, amelyek a kromoszómán levő DNS fennmaradó részét védik az élőlény élete során.
Szóval, miről is van szó. A telomérák az eukarióta kromoszómák végén levő rövid, ismétlődő szakaszok, amelyek a kromoszómán levő DNS fennmaradó részét védik az élőlény élete során.
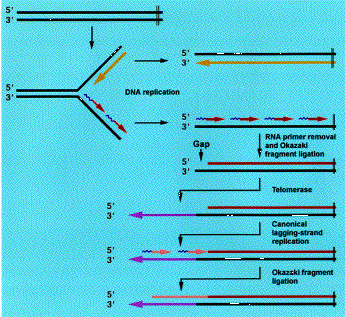 De mire való ez a furcsa rendszer? Az egészre az eukarióta sejtek sajátosságai, és a DNS másolás sutasága miatt van szükség. Ez a sutaság abból ered, hogy a DNS polimerázok csak 5'-3' irányban képesek dolgozni.
De mire való ez a furcsa rendszer? Az egészre az eukarióta sejtek sajátosságai, és a DNS másolás sutasága miatt van szükség. Ez a sutaság abból ered, hogy a DNS polimerázok csak 5'-3' irányban képesek dolgozni.
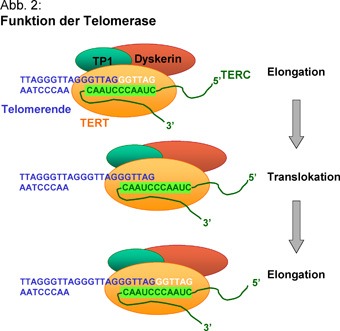 A sejtekben a polimerázok mellett nukleázok is találhatók, olyan enzimek, amelyek DNS-t emésztenek, különösen akkor, ha az egyszálú és a vége a semmibe lóg. (Megj: baktériumok esetében a DNS körkörös plazmidokon helyezkedik el, ott nem is létezik ez az egész probléma.) Azaz minden egyes sejtosztódáskor a kormoszómák végéből lecsípődne egy darab. Ez nem lenne túlzottan adaptív, és erre jelentenek megoldást a telomérák és a telomeráz enzim.
A sejtekben a polimerázok mellett nukleázok is találhatók, olyan enzimek, amelyek DNS-t emésztenek, különösen akkor, ha az egyszálú és a vége a semmibe lóg. (Megj: baktériumok esetében a DNS körkörös plazmidokon helyezkedik el, ott nem is létezik ez az egész probléma.) Azaz minden egyes sejtosztódáskor a kormoszómák végéből lecsípődne egy darab. Ez nem lenne túlzottan adaptív, és erre jelentenek megoldást a telomérák és a telomeráz enzim.

Utolsó kommentek