
Ma százötven éve. És még mindig aktuális.


Ma százötven éve. És még mindig aktuális.

Kb. Szkeptikusékkal egyidőben figyeltem fel, a világ leghatásosabb kacsamájkivonatára, az Oscillococcinumra és egy picit meglepődtem.
Na nem azon, hogy a Boiron egy újabb bizonyíthatatlan hatású szerrel kufárkodik, hanem azon, hogy itt egyértelműen egy "gyógyszer" reklámját láthatjuk. Ahhoz egy idő után hozzászokik (belefásul ?) az ember, hogy mindenfajta kufárok a legvalószínűtlenebb csodaszereket képesek rásózni a mit sem sejtő emberekre, azt a kiskaput kihasználva, hogy "táplálékkiegészítőként" regisztrálják a portékájukat. De azt valahogy még így is evidenciának éreztem, hogy OGYI számot és így gyógyszer megnevezést csak olyan szer kaphat, amelynek hatásosságát klinikai tesztek igazolták (így utólag valszleg naiv voltam, vagy tudatlan).
Ebből kiindulva írtam tehát az Országos Gyógyszerészeti Intézetnek (OGYI), hogy megtudjam, most a Boiron szórakozik velünk, és valójában egy táplálékkiegészítőt reklámoznak gyógyszerként, vagy valami homokszem csúszott a gépezetbe, és tényleg kiadtak egy OGYI számot az Oscillococcinumra.
Ma érkezett a válasz:
Most már csak azt szeretném tudni, hogy milyen (hol publikált) klinikai vizsgálatokra támaszkodik az OGYI az ehhez hasonló homeopátiás készítmények engedélyezésekor. Remélhetőleg tíz nap múlva ez is kiderül.
(Egyébként a Boiron reklámján egyértelműen "gyógyszer" szerepel és nem "homeopátiás gyógyszer", de gondolom a vonatkozó jogszabályok megfelelően engedékenyek ilyen esetekben, ha a dobozon a helyes megnevezés szerepel. Na nem mintha ez lenne itt a legnagyobb gond ... :-/.)
 Régóta lóg a levegőben a korábbi ígéretem, hogy kicsit behatóbban is foglalkozunk az aktuális influenza vírussal és azt hiszem a mostani hisztériánál keresve sem lehetne jobb időzítést találni.
Régóta lóg a levegőben a korábbi ígéretem, hogy kicsit behatóbban is foglalkozunk az aktuális influenza vírussal és azt hiszem a mostani hisztériánál keresve sem lehetne jobb időzítést találni.
Természetesen egy sorban is el lehetne intézni, hogy most akkor veszélyes-e a vírus, vagy sem, kell oltani, vagy sem, de mivel e legtöbb félreértés érzésem szerint abból ered, hogy sokaknak fogalmuk sincs miről beszélnek, egy kicsit mélyebben elmerülünk a témában. Végigvesszük, hogy akkor most pontosan hogyan is néz ki az influenza vírus, miképpen működik, mit tudunk a patomechanizmusáról a korábbi nagy influenzajárványok alapján. Miért kellhet az oltás, kell-e félni tőle, sőt még abba is megpróbálok belemenni, hogy miért hatékonytalan az oltás körüli kommunikáció és miért nem triviális ezen változtatni.
A vírus biológiája
Az Orthomyxoviridae családba tartozó influenzavírusoknak három nagy típusa ismert, A, B és C, amelyek közül az első a messze legelterjedtebb és legváltozatosabb. Az egyes vírusok konkrét nevét a felszínükön levő hemagglutinin (HA) és neuraminidáz (NA) fehérjék altípusa alapján képezzük (előbbinek 16 altípusa, mígutóbbinak 9 altípusa ismert), így a H1N1 az arra vonatkozik, hogy a vírus felszínén az egyes altípusokba tartozó HA és NA lelhető fel. Persze a nomenklatúra közel sem tökéletes, hiszen az influenza vírus természetét az összes génje együtt határozza meg (erről lásd egy picit később) - mi sem példázza ezt jobban, mint hogy a legendás "spanyolnátha" is H1N1 volt, meg az azóta megszelídült, szezonális influenzaként fel-feltűnő utódai is azok. Olyannyira, hogy az aktuális szezonális influenza - amely hosszú évek óta az emberekben köröz -, szintén H1N1, ezért a szakirodalom, a sertés influenzát 2009 A(H1N1) néven ismeri (én is így fogom használni), a félreértéseket elkerülendő.
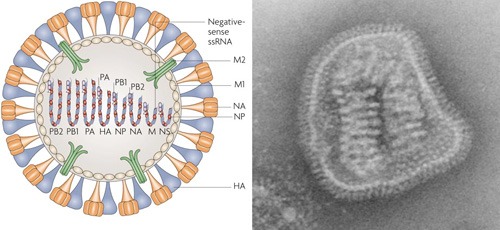 Az influenza vírusoknak jellegzetes, negatív szálú RNS genomja van, amely 8 ún. szegmensen helyezkedik el. Ezeken a szegmenseken kódolódnak a vírus működéséhez szükséges fehérjék (többé-kevésbé egy fehérje/szegmens), amelyekről szép sorjában mindjárt meg is emlékezünk. Alapállapotban (amikor a vírus részecske formában létezik) az RNS szálak körül virális nukleoproteinek (NP) találhatók, amelyek a szegmensek stabilitásáért felelősek. Ezek mellett kis mennyiségű virális polimeráz (PB1 és PB2) is fellelhető a vírus belsejében, amelyeknek a feladata, hogy fertőzés után elkezdják átírni az influenza RNS-eket (mivel értelemszerűem maguk is kódolva vannak a genomban, a folyamat a fehérjék exponenciális megjelenését okozza). A virális genom szegmenseken való elhelyezkedése az ún. reasszortáció jelenségének az oka. (Ez akkor következik be, amikor több, különböző influenza vírus fertőzi meg ugyanazt a sejtet, és a keletkező új virionokba az eredeti vírusok szegmenseinek véletlenszerű kombinációja kerül. Ez új vírus törzsek kialakulását okozhatja, amelyek könnyen veszélyesebbek lehetnek, mint bármely szülői vírus.)
Az influenza vírusoknak jellegzetes, negatív szálú RNS genomja van, amely 8 ún. szegmensen helyezkedik el. Ezeken a szegmenseken kódolódnak a vírus működéséhez szükséges fehérjék (többé-kevésbé egy fehérje/szegmens), amelyekről szép sorjában mindjárt meg is emlékezünk. Alapállapotban (amikor a vírus részecske formában létezik) az RNS szálak körül virális nukleoproteinek (NP) találhatók, amelyek a szegmensek stabilitásáért felelősek. Ezek mellett kis mennyiségű virális polimeráz (PB1 és PB2) is fellelhető a vírus belsejében, amelyeknek a feladata, hogy fertőzés után elkezdják átírni az influenza RNS-eket (mivel értelemszerűem maguk is kódolva vannak a genomban, a folyamat a fehérjék exponenciális megjelenését okozza). A virális genom szegmenseken való elhelyezkedése az ún. reasszortáció jelenségének az oka. (Ez akkor következik be, amikor több, különböző influenza vírus fertőzi meg ugyanazt a sejtet, és a keletkező új virionokba az eredeti vírusok szegmenseinek véletlenszerű kombinációja kerül. Ez új vírus törzsek kialakulását okozhatja, amelyek könnyen veszélyesebbek lehetnek, mint bármely szülői vírus.)
A szegmensek körül egy speciális burok található, amelyet az M1 fehérje alakít ki, és amelynek feladata a vírus összeszerelésében van, legkívül pedig a HA-val, NA-val és az M2 nevű ioncsatornával teletűzdelt lipidmembránt leljük.
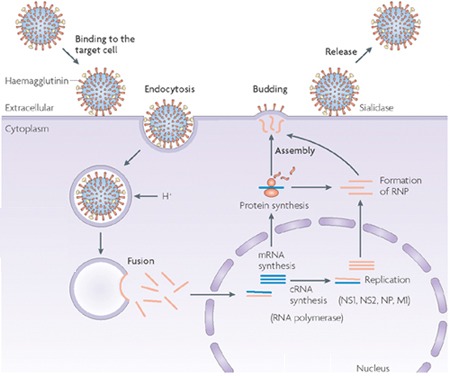 Fertőzéskor a vírus HA fehérjéi révén kötődik a sejtfelszínen található glycoproteinekhez és glycolipidekhez kapcsolódó sziálsav csoportokhoz, és a kötődés nyomán megindul a vírusrészecske bekebelezése endocitózis révén.
Fertőzéskor a vírus HA fehérjéi révén kötődik a sejtfelszínen található glycoproteinekhez és glycolipidekhez kapcsolódó sziálsav csoportokhoz, és a kötődés nyomán megindul a vírusrészecske bekebelezése endocitózis révén.
Az endocitotikus vakuólákban a közeg savassága megnő, és ez hozzájárul egyrészt, hogy a vírus és a vakuóla membránja összeolvadjon, másrészt megnyitja az M2 csatornákat és azokon keresztül savasítja a virion belsejét. Utóbbi fontos, hogy az M1-hez kötődő RNS-ek és NP-ek kiszabadulhassanak és a sejt belsejébe kerüljenek.
A membránfúzió előfeltétele a HA proteolitikus hasítása, enélkül a fertőzés esélytelen. Olyannyira igaz ez, hogy alapvetően megszabja egy fertőzés jellegét, hogy mennyire könnyű hasítani az azt okozó influenza vírus HA fehérjéjét. A "klasszikus" esetekben csak az alsó légutakban vannak olyan proteázok amelyek képesek a HA-t hasítani. Virulensebb törzsek esetében (és ilyen volt a pár évvel ezelőtti H5N1 madárinfluenza) azonban a HA szekvenciája lehetővé teszi, hogy más szövetekben fellelhető proteázok is hasítsák, ami nagyban megnöveli a megfertőzhető sejtek számát, súlyosbítva a tüneteket, szövődményeket okozva.
A sejtbe kerülve, a vírus negatív szálú RNS-ei és a velük együtt levő PB1 ill. PB2 molekulák a sejtmagba transzportálódnak, ahol elkezdődik a vírusban kódolt információ átírása mRNS-be, majd a sejt fehérje készítő apparátusát felhasználva (hiszen ez nem tesz különbséget a saját és a virális mRNS molekulák között) létrejönnek a vírus fehérjéi is. A folyamat öngerjesztő és hamarosan az egész sejt annak az egy funkciónak lesz alárendelve, hogy virális RNS-eket és fehérjéket gyártson. (A sejt nem teljesen védtelen az ilyen betolakodókkal szemben, épp ezért az egyik virális fehérje, az NS1 feladata, hogy kilője a gazda természetes immunitását beindító interferonokat.)
Az újonnan elkészült HA, NP és M2 molekulák az endoplazmatikus retikulum, ill. Golgi-rendszer membránjain keresztül (azaz a standard membrán szekréciós útvonalon) a sejt felszínére jutnak. Közben az M1 már elkezd a sejt citoplazmájába lógó, ún. intracelluláris doménjeikhez kapcsolódni, és az M1 fogja (pontosan még nem ismert módon) a virális RNS-eket, valamint az őket burkoló NP-eket a membárnhoz vonzani ill. kötni. Végül a komplett vírus lefűződik a sejt membránjából és útjára indul, új áldozatot keresni (itt látható egy kis videó a folyamatról).
Ebben az utolsó lépésben kapnak szerepet a NA fehérjék, amelyek feladata, hogy a vírus részecske saját membránján levő sziálsav csoportokat levágják. Így a virion nem kötődhet a sejt felszínén levő más HA fehérjékhez, illetve a virionok nem is fognak összetapadni. Működőképes NA hiányában a fertőzés nem képes tovább terjedni.
Kis vírustörténelem
Bár az influenza vírusok minden bizonnyal időtlen idők óta velünk vannak, az efajta zanzásított történeti összefoglalók alfája minden esetben 1918. Ekkor következett be a nagy spanyolnátha járvány (bővebben erről lásd Nádori kollegánál), amely egyes becslések szerint több mint 50 millió ember haláláért tehető felelőssé. Még ha egy picit szkeptikusan tekintünk is erre a számra (hogy erre esetleg miért lehet okunk, arról lásd később), akkor is közel milliós nagyságrendűre tehető a halottak száma. A spanyolnáthát okozó H1N1 leszármazottai keringtek aztán a humán populációkban, a szezonális influenza okozóiként, egészen 1957-ig. Ekkor egy reasszortáció eredményeként egy új vírustörzs jelent meg, amelynek új HA és NA génjei voltak, ez az 1957-es H2N2, az "ázsiai influenza járvány" okozója, amely 2 millió életet követelt.A következő járványra tíz évet kellet várni, ekkor a H2N2-ből reasszortáció útján H3N2 lett és kitört a "hong kongi influenza". Mivel az NA fehérje ez esetben nem változott, a járvány nem fellángolás szerű lett, hanem inkább csak lassan (de biztosan) izzó parázsként tette a dolgát.
Az 1968-as H3N2 leszármazottai hosszú ideig boldogítottak még bennünket, majd 1977-ben ismét feltűntek a H1N1 típusú vírusok is, így évekig két fajta szezonális influenzának lehetett örülni (ami kiszámíthatatlanabbá tette az oltási felkészüléseket is).
Komolyabb parára ismét csak 1997 tájékán került sor; ekkora datálható a H5N1 "madárinfluenza" megjelenése. Ez ismét Hong-Kongban következett be (a vízi szárnyasok, amelyek igen kedvelt táplálékforrások errefele, amúgy is elsődleges hordozói az influenza vírusoknak és a városállam piacain levő zsúfoltság finom szólva sem hátrányos az egyes vírusok elterjedése során), de egy masszív mészárlási kampányt követően úgy tűnt, sikerült a dolgot még időben megfékezni. 2003-ig kellett várni, hogy kiderüljön, nem egészen. Mivel a vírus nem tud (még ?) sikeresen emberről emberre terjedni, azóta világszerte mindössze kb. 300 ember betegedett meg H5N1 fertőzés következtében (elsőroban K-Ázsiában), a fatalitási arány viszont sokkolóan magas: kb. 60%-os.
A nagy kérdés, hogy mi okozta/okozza az 1918 H1N1, ill. H5N1 vírusok magas virulenciáját. A szegmensekkénti vizsgálat (kvázi arról van szó, hogy egy viszonylag ártalmatlan, szezonális influenza törzs szegmenseit egyenként helyettesítik a vizsgált vírusok megfelelő szegmenseivel, és nézik, miként változik a letalitás, egerekben) mindkét esetekben a HA, NA, NS1 ill. polimeráz fehérjéket tette felelőssé.
Mindkét vírusnál a HA-ban olyan változások jelentek meg, amelyek könnyebbé teszik a hasításukat, így, mint erre korábban már utaltam, többfajta szövetet képesek megfertőzni. Az NA változása valószínűleg a HA sziálsav felismerését optimalizálta; az NS1 mutációi pedig még hatékonyabbá tették a természetes immunrendszer kikapcsolását. Ezek teljesen logikusnak tűnnek, a polimeráz enzimek virulenciához való viszonya talán egy hangyányit rejtélyesebb, de az is megmagyarázható. Arról van ugyanis szó, hogy különböző polimerázok, különböző hőmérsékleten működnek optimálisan. Pl. a humán légutak átlaghőmérséklete 33 C, a madar beleié pedig 41 C. Amikor a vírus új fajokat, vagy ugyanazon a fajon belül új szöveteket akar kolonizálni, nem árt, ha a polimeráz enzimjei az új környezetben is működőképesek lesznek.
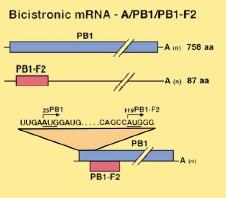 A polimeráz génekhez kapcsolódó virulencia legérdekesebb összetevője azonban nem maguk a polimeráz fehérjék, hanem a PB1 szegmensen időnként feltűnő, ún. PB1-F2 fehérje. Az F2 itt a "frame 2" rövidítése, ami arra utal, hogy ugyanazokat a bázisokat felhasználva, amelyek a PB1 polimerázt kódolják, de egy bázispárral eltolva a leolvasási keretet, egy másik fehérjét (is) kapunk. A PB1-F2 a sejtekben levő mitokondriumokhoz képes kapcsolódni, és azokon keresztül beindítani a sejthalál, azaz apoptózis folyamatát.
A polimeráz génekhez kapcsolódó virulencia legérdekesebb összetevője azonban nem maguk a polimeráz fehérjék, hanem a PB1 szegmensen időnként feltűnő, ún. PB1-F2 fehérje. Az F2 itt a "frame 2" rövidítése, ami arra utal, hogy ugyanazokat a bázisokat felhasználva, amelyek a PB1 polimerázt kódolják, de egy bázispárral eltolva a leolvasási keretet, egy másik fehérjét (is) kapunk. A PB1-F2 a sejtekben levő mitokondriumokhoz képes kapcsolódni, és azokon keresztül beindítani a sejthalál, azaz apoptózis folyamatát.
Mivel a 2009 A(H1N1) esetében a PB1-F2 nem funkcionális (több STOP kodon is szerepel a leolvasási keretében), páran felvetették, hogy valószínűleg nem kell komoly szövődményű betegségtől tartani. Ugyanakkor ennek némileg ellentmond, hogy a spanyolnátha esetében a virulencia legfőbb komponense nem a PB1-F2, hanem egyértelműen a HA volt, ráadásul viszonylag friss szekvencianalaízisek azt mutatják, hogy a PB1-F2 nem létfontosságú az A típusú influenza vírusok fitnessze szempontjából. Így leginkább annyit mondhatunk biztosan, hogy a PB1-F2 hiányában a vírus nem lesz annyira pusztító, mint amennyire lehetne.
Szezonalitás
Az influenza vírusok elsősorban télen, ill. kora tavasszal tarolnak. Ez alól nem nagyon van kivétel, ha megnézzük az alábbi ábrán jól láthatjuk, hogy minden féltekén a hideg hónapok során csúcsosodik ki az aktuális szezonális járvány, a melegebb égöveken pedig egész évben egy alapszintű influenza aktivitás érzékelhető.
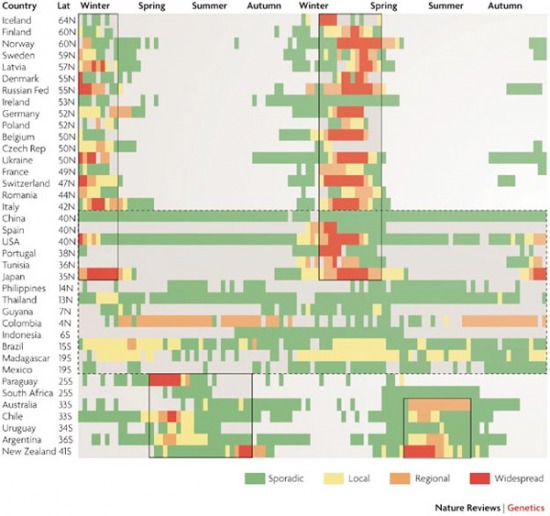
A nagy kérdés a mi ennek az oka. Igazából fogalmunk sincs, hogy miért pont a téli hónapok az influenza vírusok kedvencei, de több hipotézis kering kutatói körökben. Az egyik, hogy a téli hónapokra jellemző össze- és bezártság megkönnyíti a vírus terjedését. De az is szóba került, hogy a vírus stabilitása jobb a hidegben, esetleg az emberi immunitás szezonális változása (a napfény függő melatonin szekréció, illetve D vitamin termelés egyaránt összefüggésbe hozható az immunválasszal) az oka annak, amit látunk. Egy ma már kevésbé népszerű, de még teljesen meg nem cáfolt nézet pedig azt állítja, hogy az influenza valamilyen más kórokozóval karöltve tud igazából betegséget okozni, és az influenza járványok szezonalitását, a misztikus patogén határozza meg. Akárhogy is van, a 2009 A(H1N1) szempontjából most következik a feketeleves a mi féltekénken.
Influenza vs. "influenzaszerű"
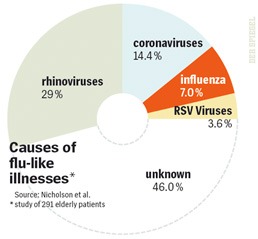 Az influenzával kapcsolatos vizsgálatok (beleértve az oltóanyagok hatékonyságát) egyik rákfenéje, hogy a tünetek elég általánosak. Az "influenzaszerű" megbetegedéseknek valójában csak a töredéke valóban influenza (mint az a Spiegel cikkéből vett ábrán is látszik), de a statisztikákba gyakran influenzaként vonulnak mégis be.
Az influenzával kapcsolatos vizsgálatok (beleértve az oltóanyagok hatékonyságát) egyik rákfenéje, hogy a tünetek elég általánosak. Az "influenzaszerű" megbetegedéseknek valójában csak a töredéke valóban influenza (mint az a Spiegel cikkéből vett ábrán is látszik), de a statisztikákba gyakran influenzaként vonulnak mégis be.
E miatt kell egy kicsit óvatosan bánni a spanyolnátha 50 millió halottjával is. Kétségtelen, hogy egy durván virulens A(H1N1) törzs tombolt világszerte 1918-ban, de a korabeli egészségügyi normákat és felkészültséget figyelmbe véve, nem zárható ki, hogy a halálozások jelentős részét nem minden esetben az influenza vírus okozta, hanem vagy egy másik vírus, vagy egy bakteriális fertőzés (az antibiotikumok előtti időkről van végül is szó), vagy ezek és az influenza kombinációja.
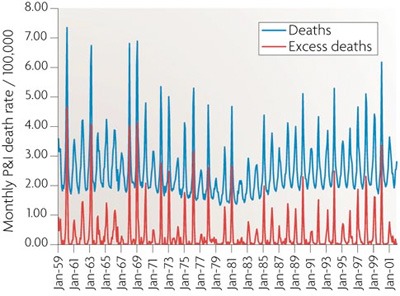 Ami persze nem azt jelenti, hogy valójában az influenza vírus nem káros, vagy akár halálos bizonyos esetekben. A halálos kimenetelű légzőszervi megbetegedések (pneumonia and influenza - P&I index) száma mindig durván megugrik a szezonális influenza járványok idején, és ha megfelelő korrekciókat alkalmazva levonjuk a más légzőszervi patogének okozta megbetegedéseket, egyértelműen látható, hogy bizony, az influenza minden évben számos halálesetért felelős. (Amerikában egyedül ez a szám évi 36,000 köré tehető.)
Ami persze nem azt jelenti, hogy valójában az influenza vírus nem káros, vagy akár halálos bizonyos esetekben. A halálos kimenetelű légzőszervi megbetegedések (pneumonia and influenza - P&I index) száma mindig durván megugrik a szezonális influenza járványok idején, és ha megfelelő korrekciókat alkalmazva levonjuk a más légzőszervi patogének okozta megbetegedéseket, egyértelműen látható, hogy bizony, az influenza minden évben számos halálesetért felelős. (Amerikában egyedül ez a szám évi 36,000 köré tehető.)
A legveszélyeztetettebb kategóriát általában a más betegségekben szenvedők, illetve az öregek képezik, akiknek az immunrendszere nem képes elég hamar és elég alaposan felvenni a harcot a betolakodók ellen.
A 2009 A(H1N1) molekuláris eredete
 Akkor ennyi általános bevezető után elérkeztünk a biológiailag nagyon is releváns és izgalmas kérdéshez, honnan ered a "sertésinfluenza" vírusa.
Akkor ennyi általános bevezető után elérkeztünk a biológiailag nagyon is releváns és izgalmas kérdéshez, honnan ered a "sertésinfluenza" vírusa.
A történetünk szempontjából "klassszikusnak" számító sertésinfluenza vírus, akár csak az ember esetében (lásd fenti történeti kitekintőt), az 1918-as H1N1 járványra datálható. Ugyan disznókból az első influenza vírusokat csak a harmincas években sikerült izolálni, azok molekulárisan a "spanyolnátha" közeli rokonai voltak, és azok is maradtak a kilencvenes évek végéig.
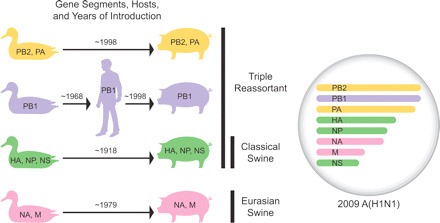
1998 körül a "klasszikus" sertésvírus, az akkor éppen aktuális emberi H3N2, valamint egy ismeretlen altípusú madárinfluenza reasszortációja egy ún. tripla reasszortáns rH3N2 kialakulásához vezetett az É-Amerikai kontinensen. Ezt hamarosan megspékelte a rH3N2 és a klasszikus sertés H1N1 közti keveredés, majd ezek a (továbbra is tripla reasszortánsnak nevezett) vírusok keringtek évekig a sertések körében. Ugyan időnként mind a "klasszikus" mind a tripla reasszortáns vírust kimutatták emberben is, a betegség nem bizonyult fertőzőnek.
A változás idén következett be, és okozója (na mi más), mint egy újabb reasszortáció volt. Az eurázsiai disznók saját sertésinfluenzája (ami 1979 körül született, egy madárinfluenzából) is sikeresen eljutott az újvilágba, és keveredett a tripla reasszortánssal (megj: lassan olyan "egyszerű" lesz követni az egyes szegmensek sorsát, mint az itt a piros, hol a piros golyóit, de remélem az ábra segít). Az így megérkező NA és M szegmensekkel aztán a virális puzzle utolsó darabjai is a helyükre kerültek, és hamarosan a vírus elindulhatott hódító útjára bennünk, emberekben is.
Patomechanizmus, avagy mit csinál a vírus a szervezetben
A vírus elsősorban szaporodik, nincs neki komolyabb terve a gazdával. Az már szinte mellékhatás, hogy sok esetben ez azzal jár, hogy az inkubátornak átprogramozott sejtek elpusztulnak. Attól függően, hogy hol és mennyire vadul szaporodik a vírus (ami, mint fent taglaltuk a polimerázok aktivitásától függ, na meg persze a HA hasíthatóságától) lehet a tüneteket felfedezni. Különleges esetekben a vírus átterjedhet a légutakon túl a belekre, a vesére, ill. limfoid szerveinkre .
A 2009 A(H1N1)-en végzett kezdeti vizsgálatok az influenzológusok kedvenc modelállatában, a menyétben (igen, menyétben - azért menyét, mert a légutainak sejtjei nagyon hasonlóak a humán ekvivalenseikhez, és kb. ua. a vírusokra érzékenyek is), azt sugallták, hogy a szezonális influenzánál sokkal virulensebb vírussal állunk szemben, amely ugyan terjedni nem terjed jobban, mint a "klasszikus" H1N1, de jobban szaporodik a légúti szövetekben, több kárt okoz bennük és a 2009 A(H1N1)-el fertőzött állatok nagyobb eséllyel pusztulnak bele a fertőzésbe.
Minden modelállatnak megvannak a maga korlátai és úgy néz ki a menyét esetében is elértünk egy ilyenhez. Talán azért mert megbízhatóságát eddig főleg a H5N1, vagyis madárinfluenza elleni küzdelemben tesztelték, talán más okból, de úgy néz ki, hogy a szóbanforgó kutatások két kulcs következtetése nem bizonyult igaznak: a 2009 A(H1N1) vírus általában (és erre még azonnal visszatérünk) nem okoz durvább fertőzést, mint szezonális rokona, viszont sokkal fertőzőbb - Amerikában a bizonyított influenza esetek 99%-át okozta az új törzs. [A legfrissebb becslések szerint, július végéig kb 1.8 - 5.7 millió ember betegedhetett meg az Egyesült Államokban, amiből 9,000 -21,000 igényelt korházi kezelést (nem mindig végezték el a tesztet, illetve a jelenlegi gyors tesztek sajnos nem túl hatékonyak, ezért a bizonytalanság). A bizonyított H1N1-el kezelt, kórházban levő betegek kb. 6%-a nem élte túl a fertőzést.]
Makákókban végzett további kísérletek arra világítottak rá, hogy a vírus jól terjed az alsó légutakban is, és talán pont sokkal jobb szaporodási képességének köszönhetően, nagyobb kárt okoz a tüdő szövetekben.
Az egyelőre rendelkezésünkre álló mortalitási adatokból kitűnik, hogy főként más betegségekben is szenvedők számára veszélyes a fertőzés. Ugyanakkor az is tény, hogy számos korházban kezelt betegnél nem ismerhető fel más betegség, vagyis a 2009 A(H1N1), minden mende-monda ellenére igencsak hatékony patogén. Hogy mi okozhatja a különböző betegekben a különböző súlyú megbetegedést, arról leginkább találgatni tudunk. Az egyik lehetőség, hogy bizonyos személyekben a korábbi szezonális influenzák ellen kialakult ellenanyagok (végső soron valamennyire minden H1N1 hasonlít) hatékonyabbá teszik az immunválaszt, de pontos ismereteink még nincsenek a dologról.
Amikor azonban súlyossá válik a dolog, a tüdőben masszív gyulladás alakul ki, ami viszont folyadékfelhalmozódáshoz vezet a légutakban, súlyos esetekben akár bevérzéshez is. Ezek következtében az oxigéncsere nem tud megvalósulni, hiába lélegzik egyre mélyebbeket a beteg.
Oltani, vagy nem oltani, ez itt a kérdésAz oltásokról mára már kb. mindenki mondott valamit, és aki csak a napi médiából próbál tájékozódni, annak bizony nincs könnyű dolga. Hiszen egyrészről, ha Czeizel Endre valamiért "tűzbe teszi a kezét", akkor jobb, ha annak magunk is utána olvasunk, legyen szó örökbefogadásról, vagy abszolút hallásról. Ugyanakkor, amikor Lenkei "gyógyítsuk az AIDS-t C vitaminnal" Gábor le akar beszélni egy oltásról, szinte teljesen biztosak lehetünk benne, hogy a vakcina jó és hatékony.
A "csippet ültetnek belénk" és hasonló baromságokkal most nem foglalkoznék, de próbáljuk meg érdemlegesen felmérni, hogy kell-e a vakcina: pontosabban hatásos-e, és hatása ellensúlyozza-e potenciális mellékhatásait.
Az orvosi eljárások hatékonyságát metaanalízisekben vizsgáló Cochrane Collaboration elég egyértelműen fogalmaz: különösen nagyon elterjedt vírusok esetében, főleg ha a járványt kiváltó kórokozó és az oltóanyag elkészítéséhez felhasznált vírus nagyon hasonló, egyértelműen megfigyelhető a hatás. Az elterjedtség az kipipálható, és az Omninvest által felhasznált vírus (A/California/7/2009(H1N1)-szerű NYMC X-179A) is rajta van a WHO ajánlási listáján (bármilyen baromságokat terjeszt is dr. Tóth Kálmán), vagyis ezek alapján nem köthetünk bele az oltásba.
Az egyik leggyakrabban felmerülő mellékhatás, az ún. Guillain-Barré szindróma, egy ritka autoimmun betegség kialakulása. Ennek az esélye standard esetben egy a millióhoz, amit azonban nem árt kontextusba tenni: maga az influenza fertőzés is kiválthatja a szindrómát és ennek az esélye nagyságrendileg nagyobb lehet.
Az oltás jelentősége természetesen többrétű: egyrészt megóvhatja az egyént is a fertőzéstől, másrészt lecsökkentve a vírus terjedési potenciálját és így csökken annak is az esélye, hogy a veszélyeztetett csoportokban megjelenjen a fertőzés.
 A vírus fertőzési potenciálját az ún. fertőzési szám, az R0 írja le, ami durván azt tükrözi, hogy egy beteg hány más személynek adja át a fertőzést (bővebben erről matematikus barátainknál lehet olvasni). A feladat most is az, hogy R0-t 1 alá szorítsuk.
A vírus fertőzési potenciálját az ún. fertőzési szám, az R0 írja le, ami durván azt tükrözi, hogy egy beteg hány más személynek adja át a fertőzést (bővebben erről matematikus barátainknál lehet olvasni). A feladat most is az, hogy R0-t 1 alá szorítsuk.
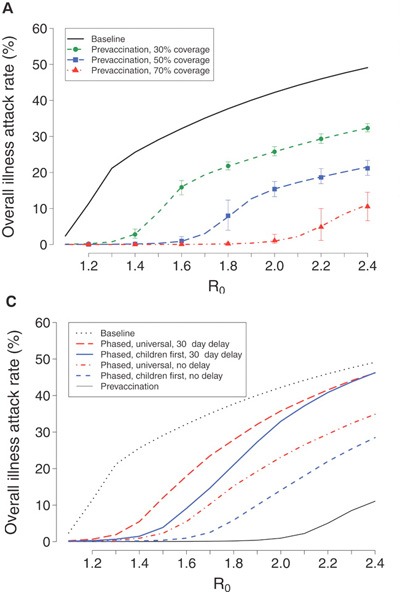
De mennyi is akkor a 2009 A(H1N1) reprodukciós száma? A konzervatív becslések egyelőre 1.3 - 1.7 közé esnek, de a felső határ az bizony 2.1. Ebből látható, hogy az 50-70% közti oltási arány lenne a kívánatos , amennyiben sikerülne a lakosságot a járvány kitörése előtt beoltani.
Ha erről lekésünk, akkor már eleve a 70%-os lefedettséget kellene becélozni, de értelemszerűen csak szerényebb reményeink lehetnek. Ugyanis, ha a reprodukciós szám stabilan 1.5 fölé kúszik, mindenképpen kitör a járvány, annak csak a mértékét és lefolyását tudjuk befolyásolni.
Stratégiailag, főleg ha a készletek elérhetősége adott pillanatban korlátozott, annak van/lesz a legtöbb értelme, hogy a gyerekeket beoltjuk, és ezt követően, amint lehet a felnőtt lakosságra is kiterjesztjük az oltási kampányt. (A gyerekek beoltása azért sem elhanyagolható, mert a becslések szerint a fertőzések közel ötöde az iskolákban következik be.)
Ami miatt a 2009 A(H1N1) különlegesnek tűnik, más (szezonális) influenza vírusokkal összevetve, az az idősek (65 év felettiek) relatív védettsége. Klasszikusan ugyan ez a legkiszolgáltatottabb csoportok egyike, ahol még mindig nem bizonyított, hogy az oltás valóban hatásos-e. Ennek az oka, hogy az idősekben gyakran gyengébb az immunválasz az új kórokozókkal szemben (és ezért nagyon fontos, hogy az idősek közt dolgozó ápolók időben kapjanak oltást).
Most azonban ez a korosztály nyugodtan alhat, mert a járvány pont a szezonális influenzától általában legkevésbé veszélyeztetett, 18-49 éves korosztály körében tombol igazán.
A dolog "miértje" kicsit enigmatikus, de furcsa módon úgy tűnik, hogy a válasz egy része pont a spanyolnáthában rejlik.
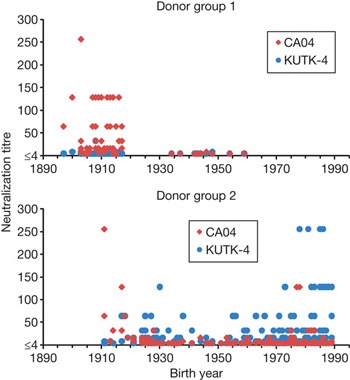
A jobboldalon látható ábra azt mutatja, hogy mennyi ellenanyagot lehet felfedezni egyes vérszérumokban egy Kaliforniában tavasszal izolált sertésinfluenza vírussal (CA04), illetve egy Japánban épp "honos" szezonális influenzával (KUTK-4) szemben. Az első csoport (donor group I) mintáját 1999-ben izolálták egy öregek otthonában az ott lakók, ill. ápolóik véréből, míg a másik minta (donor group 2) idén készült egy kórházban.
Látható, hogy asz aktuális szezonális influenza ellen értelemszerűen nem létezett védelem még 1999-ben, semelyik korosztályban sem. Ugyanakkor az 1918 előtt születettek vérében nagyon hatékony 2009 A(H1N1) elleni ellenanyagok vannak. Ez arra enged következtetni, hogy a mostani vírus külseje jobban hasonlít a spanyolnátha kórokozójára, mint a szezonális H1N1 influenzák.
Ez nyilván a magyarázat egyik része csak, mert azt még mindig nem értjük, hogy a 65-90 év közötti korosztály pontosan mitől védett.
(Érdekes és kicsit paradox módon a jelenlegi helyzet vezethet ahhoz, hogy olyan logikával oltsuk, ahogy egyébként is kellene. Matematikai modellek azt mutatják, hogy szezonális influenzák esetében is az iskolások és az aktív dolgozók kellene az oltási kampányok elsődleges alanyai legyenek, hiszen az ő esetükben a legnagyobb az esélye, hogy tovább adják a vírust.)
 A legjobb persze a megelőzés, és itt azért nem sok változott az elmúlt 80 évben. Ma is az elsődleges tanács az, hogy tarts be alapvető higiéniai előírásokat, gyakran moss kezet, ne nyúlj koszos kézzel a szemedbe, ha beteg vagy maradj otthon. Csak ma már komoly empirikus irodalom is alátámasztja az efajta "népi bölcsességeket".
A legjobb persze a megelőzés, és itt azért nem sok változott az elmúlt 80 évben. Ma is az elsődleges tanács az, hogy tarts be alapvető higiéniai előírásokat, gyakran moss kezet, ne nyúlj koszos kézzel a szemedbe, ha beteg vagy maradj otthon. Csak ma már komoly empirikus irodalom is alátámasztja az efajta "népi bölcsességeket".
Communication error
A helyzet tehát az, hogy a tudományos tények mind azt látszanak alátámasztani, hogy a vírus könnyen veszélyesé válhat, pusztán a megfertőzöttek nagy száma nyomán (abba bele sem menjünk, hogy egy újabb reasszortációval mi jöhet létre), így indokolt az oltási kampány.
Ezzel szemben azt látjuk, mind Magyarországon, mind máshol a világban az oltási arányok épp csak elkezdtek a kétszámjegyűbe kúszni. Nem véletlenül dühöng Falus, és mérges Berencsi Gyuri bácsi. Mi ennek az oka?
Nyilván nem segít, ha pl. a legnagyobb ellenzéki párt frakcióvezetője és szóvivője kvázi az oltás ellen száll síkra, mert az efajta hangok elnyomják a párton belüli, felelősebb álláspontot képviselő egészségpolitikusok véleményét. Nem segít az sem, ha orvosok és orvosnak látszó személyek egymásnak ellentmondó információkkal bombázzák a nagyérdeműt (ne legyenek illúzióink, az a háziorvos, aki kategorikusan közli, hogy ő pedig semmi szín alatt nem olt, az nem több, mint egy modern hályogkovács, akinek minimális elképzelése van csak a témáról). Az FN.hu találgatása a médiát mentegeti és a tudomány hitelességi problémáját feszegeti, ami szvsz elég nagy butaság: a tudomány álláspontja elég egyértelmű, csak a média keres mindig ignoráns embereket, akiket "lázzadóként" állít be és így aztán valamifajta hitelességet ad elképesztő ötleteiknek.
Az egész egy bizonytalan légkört szül és mint arra pár hete a Nature szerkesztőségi kommentárja is rámutatott, a veszély ill. válság kommunikációval foglalkozó tanulmányok rendre kimutatták, hogy amikor a túlbuzgó hivatalnokok nyomást gyakorolnak a publikumra, amelyben a szkeptikus és ambivalens attitűd egyébként is elég erős, gyakran épp ellentétes hatást érnek el, főleg, ha nem foglalkoznak elég komolyan az istenadta nép aggályaival (vagy foglalkoznak, de a társadalom ezt nem így ítéli meg.)
Egy másik ok azonban szerintem abban rejlik, hogy az internetes társadalomban a skim reading vált a domináns ismeretszerzési formává. Időnként az igazság megismerése azonban több időt, elmélyülést, gondolkodást vesz igénybe (mint azt sokan, akik idáig eljutottak, tudják ;-)). Amikor viszont emberek tömegei nem veszik ehhez a fáradtságot, akkor az feltartóztathatatlanul egy rosszabb valóság kialakulása felé fog vezetni. Mint arra Lawrence Lessig a hetekben megjelent "Against Transparency" című vitairatában fogalmaz: "A Web minden elképzelhető összefüggést megmutat. A legcinikusabb lesz a legszembeötlőbb. És a véges figyelem miatt a legszembeötlőbb lesz a legstabilabb. Alaptalan következtetések lesznek levonva, karrierek dőlnek össze és nő az elidegenedés."
Ez az attitűd könnyen észrevehető számos magyar újságíró hozzáállásában. Legyen az Szily "Index" László, vagy a Reakció nénikéje (biztos van más is, de ezekbe akaratlanul is belefutottam az elmúlt hetekben). Mindkét esetben ott remeg szelíden a sorok között, hogy ennyi pénz, hát akkor nyilván jó üzlet, és ha jó üzlet gyanús. Különösen utóbbi esetben nehezen követhető a logika, mert nem világos mi a baj. Hogy túl sok vakcina lett beszerezve? (Lehet, de ehhez kellene egy levezetés, amiből egyértelmű lesz, hogy pl. az oltás nemzetgazdasági haszna (a betegség miatt kieső órák nem megtörténése) kevesebb, mint a hatmilliárd.) Hogy egy spin-off cég pénzért dolgozik? (Van olyan, amelyik nem?) Vagy hogy a cég ennyi pénzért dolgozik. (Szintén lehet, hogy az Omninvest túláraz, de ennek igazolására több kellene, mint bemondás.) Sejtetések vannak, levegőben lógó állítások, a konkrétumok szinte teljesen hiányoznak. (Most akkor a poszt írója szerint kell-e a vakcina, vagy sem?) Aki meg megfelelő háttér infók nélkül olvassa (és a többség, ne legyenek illúzióink, ilyen), az meg természetesen úgy jön el a dologtól, hogy "hát akkor mi van, most akkor kell vagy nem kell ez az oltás?".
Pedig jó lenne gyorsan kialakítani valami konszenzust, különben lehet, hogy akaratlanul is valóban egy nagy (magyar) kísérlet részeseivé válunk.
A témában még: New Scientist, Nature, The Lancet, virology blog, Effect Measure.
 Minden új, ígéretes technológia sajátos "hype" cikluson megy keresztül: először eltúlzott várakozások minimum világmegváltást remélnek tőle, majd amikor ez nem válik be keserű kiábrándulás jön és csak ezt követi a névértéken való kezelés. A génterápia a jelek szerint elért a harmadik ponthoz, bár a második szakasz talán sokkal keményebb lett, mint arra a technológia támogatói egykor számítottak.
Minden új, ígéretes technológia sajátos "hype" cikluson megy keresztül: először eltúlzott várakozások minimum világmegváltást remélnek tőle, majd amikor ez nem válik be keserű kiábrándulás jön és csak ezt követi a névértéken való kezelés. A génterápia a jelek szerint elért a harmadik ponthoz, bár a második szakasz talán sokkal keményebb lett, mint arra a technológia támogatói egykor számítottak.
A kezdetekben az eljárást leginkább halálos betegek utolsó mentsváraként alkalmazták: súlyos immunrendszeri zavarokban szenvedő gyerekekbe juttatták be a bennük hiányzó gén eredeti formáját, vírus alapú vektorok segítségével és reménykedtek, hogy helyreáll az immunműködésük. Tíz esetből nyolcban ez is történt, de a maradék két kis beteg a gyógyulásból hirtelen leukémiába esett, és mint kiderült szinte azonos okból: valahogy a retrovíruson bevitt immun gén egy vérképzésben fontos gén közelébe került, megzavart annak átíródását és ez vezetett az új megbetegedéshez.
Hosszú időre visszavetette ez a kutatásokat, mert azt a veszélyt lengette be, hogy a retrovírus-vektor genomba való beépülése nem véletlenszerű (mert ha az lenne, a humán genom nagy részét alkotó, nem kódoló repetitív szekvenciák miatt, kicsi lenne az esélye, hogy más, funkcionális gének mellé kerül), hanem előszeretettel épül be más gének mellé. Ez nem lenne teljesen meglepő, mert hasonló preferencia felmerült már az MLV esetében, de a terápiára választott vektor esetében ezt kizártnak tartották.
Bő egy évnyi fejvakarás után kiderült, hogy a beépülés valóban véletlenszerű, egyszerűen az történt, hogy a páciensbe visszajuttatott milliónyi sejt közül (mert ebben az esetben nem egyszerűen a retrovírust juttatták a szervezetbe, hanem már előkezelt sejteket ültettek vissza) egy-kettőben valóban az említett gén mellé történt az integráció, ami azt okozta, hogy a sejtek klónjai később elszaporodtak, rákot hozva létre. Ugyan ez a racionális magyarázat sovány vigasz volt a megbetegedő gyerekek számára, mégis lehetővé tette, hogy a terület továbblépjen.
Ennek eredményét pedig most olvashatjuk a Lancet-ben: olyan gyerekek látást adták vissza, akik egy ritka, genetikai betegségben szenvedtek, a Leber féle kongenitális amaurózisban (aka. Leber-betegségben (LCA)). A betegség az RPE65 gén mutációja miatt jön létre, aminek következtében a fotoreceptorok fényérzékenységét biztosító rhodopszin szintézise leáll, a sejtek pedig elpusztulnak. A philadelphiai kutatócsoport először hasonló betegségben szenvedő kutyákon próbálta ki a módszert, s mivel ott igen ígéretes eredmények születtek, nemrég áttértek a valódi emberkísérletekre. A kis páciensek retinájába injektáltak olyan génterápiás retrovírus konstrukciókat, amelyek a gén működő verzióját tartalmazták. Az eredmény elég lenyűgöző: mindössze három hónappal az eljárást követően a gyerekek, a kezelt szemükkel nemcsak árnyék-fény viszonyokat tudtak könnyen megkülönböztetni, de kifejezetten jól láttak apróbb jeleket is, sőt akár baseballozásra is képesek voltak!
Ez részben a fiatal szervezet plaszticitásának köszönhető, mert felnőttekben kevésbé drámai hatást sikerült csak elérni, de ez semmit nem von le a kísérlet fontosságából. A Science blogjában is látható két kis videó az egyik kezelt kisfiúról: az egyiken letakarják a kezelt szemét, és így kellene végighaladjon egy rövid akadálypályán, míg a másik esetben csak a kezelt szemét használhatta. A különbség magáért beszél.
Kezeletlen szem:
Kezelt szem:
Utolsó kommentek